3.1 Transformaciones en estado sólido.
![]() Durante el estudio de metales y
estructura cristalina, se destacó que diversos metales
pueden existir en más de un tipo de estructura cristalina,
dependiendo de la temperatura. El hierro, el estaño, el
manganeso y el cobalto son ejemplos de metales que tienen esta
propiedad, conocida como alotropía. En un diagrama
de equilibrio, este cambio alotrópico se indica por un
punto o puntos en la línea vertical que representa el metal
puro, tal como se muestra en la figura 6.25. En este diagrama,
el campo de solución sólida gamma está anillado.
El metal puro A y las aleaciones ricas en A sufren dos transformaciones.
Muchos de los diagramas de equilibrio que incluyen hierro, como
Fe-Si, Fe-Mo y Fe-Cr, muestran este campo de solución sólida
anillado. Como el tipo de hierro que existe en este intervalo
de temperatura es hierro gamma, el campo generalmente se llama
anillo gamma.
Durante el estudio de metales y
estructura cristalina, se destacó que diversos metales
pueden existir en más de un tipo de estructura cristalina,
dependiendo de la temperatura. El hierro, el estaño, el
manganeso y el cobalto son ejemplos de metales que tienen esta
propiedad, conocida como alotropía. En un diagrama
de equilibrio, este cambio alotrópico se indica por un
punto o puntos en la línea vertical que representa el metal
puro, tal como se muestra en la figura 6.25. En este diagrama,
el campo de solución sólida gamma está anillado.
El metal puro A y las aleaciones ricas en A sufren dos transformaciones.
Muchos de los diagramas de equilibrio que incluyen hierro, como
Fe-Si, Fe-Mo y Fe-Cr, muestran este campo de solución sólida
anillado. Como el tipo de hierro que existe en este intervalo
de temperatura es hierro gamma, el campo generalmente se llama
anillo gamma.
![]() Estos ejemplos corresponden a los
diagramas de fase de una aleación soluble totalmente en
estado sólido cuando uno de ellos, el hierro en este caso,
es alotrópico.
Estos ejemplos corresponden a los
diagramas de fase de una aleación soluble totalmente en
estado sólido cuando uno de ellos, el hierro en este caso,
es alotrópico.
![]() En un enfriamiento lento, las estructuras
que se obtienen son las indicadas en el diagrama, habitualmente
monofásicas a o g,
según las temperaturas de estabilidad del metal. Volveremos
sobre algún punto concreto de estas aleaciones en las cuestiones
por similitud a la transformación eutectoide. Esta
es la transformación que sucede en estado sólido
cuando en las fases producidas no existe solubilidad total entre
los metales. Se asemeja en cierto modo con la transformación
eutéctica por cuanto su diagrama mostraba insolubilidad
total o parcial en la zona de fases producto. En la experiencia
que se plantea en esta unidad entraremos en la casuística
de esta transformación.
En un enfriamiento lento, las estructuras
que se obtienen son las indicadas en el diagrama, habitualmente
monofásicas a o g,
según las temperaturas de estabilidad del metal. Volveremos
sobre algún punto concreto de estas aleaciones en las cuestiones
por similitud a la transformación eutectoide. Esta
es la transformación que sucede en estado sólido
cuando en las fases producidas no existe solubilidad total entre
los metales. Se asemeja en cierto modo con la transformación
eutéctica por cuanto su diagrama mostraba insolubilidad
total o parcial en la zona de fases producto. En la experiencia
que se plantea en esta unidad entraremos en la casuística
de esta transformación.
3.1.1 ALEACIÓN DE HIERRO-CARBONO,
ACEROS
![]() Comentamos esta aleación
Hierro-Carbono, la que recibe industrialmente el nombre de acero,
por cuanto contiene uno de los metales alotrópicos de mayor
importancia industrial. Muy adecuado, por tanto, para asignarle
las experiencias de esta unidad.
Comentamos esta aleación
Hierro-Carbono, la que recibe industrialmente el nombre de acero,
por cuanto contiene uno de los metales alotrópicos de mayor
importancia industrial. Muy adecuado, por tanto, para asignarle
las experiencias de esta unidad.
![]() El hierro es un metal alotrópico,
lo que significa, tal como se ha comentado anteriormente, que
puede presentarse en diversas variedades de estructuras cristalinas,
dependiendo de la temperatura a la que se encuentre. Su curva
de enfriamiento es la representada en la figura 6.26.
El hierro es un metal alotrópico,
lo que significa, tal como se ha comentado anteriormente, que
puede presentarse en diversas variedades de estructuras cristalinas,
dependiendo de la temperatura a la que se encuentre. Su curva
de enfriamiento es la representada en la figura 6.26.
 Figura 6.26. Curva de enfriamiento del hierro.
Figura 6.26. Curva de enfriamiento del hierro.![]() Al solidificar, a 1537°C, lo
hace en la forma d (delta), que pertenece
a la red cúbica de cuerpo centrado. Cuando desciende la
temperatura, a 1401°C, tiene lugar un cambio de fase reagrupándose
los átomos y dando origen a la variedad g
(gamma), la cual cristaliza en el sistema de red cúbica
de caras centradas y es no magnética. Al proseguir el enfriamiento
del metal, se presenta un nuevo cambio alotrópico a 907°C,
pasando la estructura del hierro de la variedad g,
a la a (alfa), que pertenece a la red
cúbica de cuerpo centrado y también es no magnética.
Finalmente, a 767°C, aparece un cambio en las propiedades
magnéticas del hierro a, el
cual pasa de no magnético a magnético, sin que la
estructura cristalina sufra variación alguna.
Al solidificar, a 1537°C, lo
hace en la forma d (delta), que pertenece
a la red cúbica de cuerpo centrado. Cuando desciende la
temperatura, a 1401°C, tiene lugar un cambio de fase reagrupándose
los átomos y dando origen a la variedad g
(gamma), la cual cristaliza en el sistema de red cúbica
de caras centradas y es no magnética. Al proseguir el enfriamiento
del metal, se presenta un nuevo cambio alotrópico a 907°C,
pasando la estructura del hierro de la variedad g,
a la a (alfa), que pertenece a la red
cúbica de cuerpo centrado y también es no magnética.
Finalmente, a 767°C, aparece un cambio en las propiedades
magnéticas del hierro a, el
cual pasa de no magnético a magnético, sin que la
estructura cristalina sufra variación alguna.
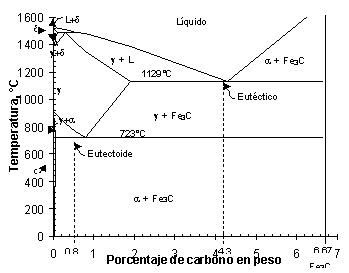
![]() La adición de elementos
de aleación al hierro, influye en las temperaturas a que
se producen las transformaciones alotrópicas. Entre estos
elementos, el más importante es el carbono, el cual al
alearse con el hierro lo hace según el diagrama de equilibrio
representado en la figura 6.27, cuyas transformaciones en estado
sólido, hasta un 2% de carbono, investigaremos en la experiencia.
La adición de elementos
de aleación al hierro, influye en las temperaturas a que
se producen las transformaciones alotrópicas. Entre estos
elementos, el más importante es el carbono, el cual al
alearse con el hierro lo hace según el diagrama de equilibrio
representado en la figura 6.27, cuyas transformaciones en estado
sólido, hasta un 2% de carbono, investigaremos en la experiencia.
![]() En realidad, es la parte del diagrama
comprendido entre el hierro puro y un compuesto intermetálico,
carburo de hierro Fe3C, que contiene el
6.67% en peso de carbono. Como vemos corresponde al diagrama de
equilibrio hierro-carburo de hierro.
En realidad, es la parte del diagrama
comprendido entre el hierro puro y un compuesto intermetálico,
carburo de hierro Fe3C, que contiene el
6.67% en peso de carbono. Como vemos corresponde al diagrama de
equilibrio hierro-carburo de hierro.
![]() En el diagrama aparecen tres líneas
horizontales, las cuales indican reacciones isotérmicas.
Consideremos la parte del diagrama situada en el ángulo
superior izquierdo de la figura, esta parte se denomina región
delta. La horizontal que corresponde a la temperatura de 1493°C
es la típica línea de una reacción peritéctica,
la que no analizamos en esta unidad.
En el diagrama aparecen tres líneas
horizontales, las cuales indican reacciones isotérmicas.
Consideremos la parte del diagrama situada en el ángulo
superior izquierdo de la figura, esta parte se denomina región
delta. La horizontal que corresponde a la temperatura de 1493°C
es la típica línea de una reacción peritéctica,
la que no analizamos en esta unidad.
![]() Como resultado de esta reacción
aparece el hierro g, denominado austenita,
con estructura de red cúbica centrada en caras. Su solubilidad
máxima en carbono se situa, a 1129°C, con un dos por
ciento aproximadamente. La zona de dominio aparece en el diagrama
como g.
Como resultado de esta reacción
aparece el hierro g, denominado austenita,
con estructura de red cúbica centrada en caras. Su solubilidad
máxima en carbono se situa, a 1129°C, con un dos por
ciento aproximadamente. La zona de dominio aparece en el diagrama
como g.
![]() La siguiente línea horizontal
es la situada a 1129°C, en la que tiene lugar la reacción
eutéctica, importante para el estudio de las fundiciones.
Corresponde al 4.3% de carbono y este eutéctico, compuesto
de austenita y cementita, se denomina ledeburita. Esta transformación
se analizó en la unidad anterior.
La siguiente línea horizontal
es la situada a 1129°C, en la que tiene lugar la reacción
eutéctica, importante para el estudio de las fundiciones.
Corresponde al 4.3% de carbono y este eutéctico, compuesto
de austenita y cementita, se denomina ledeburita. Esta transformación
se analizó en la unidad anterior.
![]() La última línea horizontal
se presenta a 723°C. Corresponde a la transformación
eutectoide, cuya investigación es el objetivo de esta unidad
didáctica.
La última línea horizontal
se presenta a 723°C. Corresponde a la transformación
eutectoide, cuya investigación es el objetivo de esta unidad
didáctica.
3.1.2 EL ANÁLISIS DILATOMÉTRICO
APLICADO A LA DETERMINACIÓN DE LOS CAMBIOS DE FASE EN ESTADO
SÓLIDO.
![]() El análisis dilatométrico
tiene como objetivo indicar el inicio y desarrollo de las transformaciones
de fase que suceden durante el proceso de enfriamiento de las
aleaciones en estado sólido.
El análisis dilatométrico
tiene como objetivo indicar el inicio y desarrollo de las transformaciones
de fase que suceden durante el proceso de enfriamiento de las
aleaciones en estado sólido.
![]() El dilatómetro puede resolver
el cambio de fase observando las variaciones de longitud de la
probeta, la que puede experimentar estas variaciones como consecuencia
de que cada fase sólida queda caracterizada por:
El dilatómetro puede resolver
el cambio de fase observando las variaciones de longitud de la
probeta, la que puede experimentar estas variaciones como consecuencia
de que cada fase sólida queda caracterizada por:
| a) | Volumen específico, Ve. | |
| b) | Coeficiente de dilatación térmica, a. |

Así pues, la diferenciación de fases es consecuencia
de:
| A. | Cuando no sucede cambio de fase: Cada estructura o fase dispone de un coeficiente de dilatación lineal característico. | |
| B. | En el transcurso del cambio de fase: El cambio de fase queda indicado por el cambio de pendiente ais motivado por el diferente volumen específico entre las fase inicial Es y producida Ei, en el campo de temperaturas qi-qs. |