
 |
| Problema 3.13
En un ensayo de difracción de rayos X, se ha determinado, para el
níquel, las distancias interplanares, de su espectro de difracción:
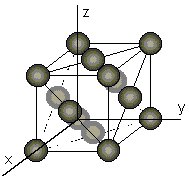
1er pico, d = 2.034 Å 2ª pico, d = 1.762 Å 3er pico, d = 1.246 Å Calcular:
a) d(200) 2º pico en redes cúbicas
Problema 3.14 El cobre tiene una estructura cúbica centrada en las caras, un radio atómico de 0.1278 nm y una masa atómica de 63.54 g/mol. Considerando a los átomos como esferas rígidas en contacto a lo largo de las diagonales de la celdilla unidad, calcular: a) la densidad teórica |
| a)
|
|
| b)
Problema 3.15 En la figura siguiente se muestran los tres primeros planos que proporcionan picos de difracción de rayos X para el aluminio, con radiación Cu Ka, l = 0,1542 nm a) Dibújese cada plano, contenido en la celda unitaria de la estructura cúbico centrado en las caras, y señálense las posiciones atómicas dentro de los planos. (realícese, mejor, un dibujo separado para cada plano) 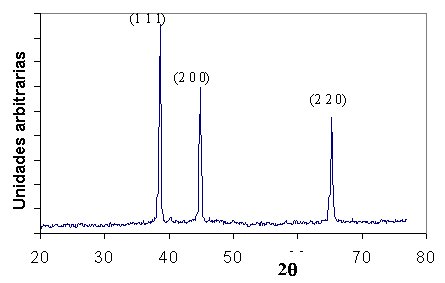 b) Empleando la ley de Bragg, d = nl/2 senq, calcúlese los ángulos de difracción (2q) para estos picos, sabiendo que el lado de la celdilla es a = 0,404 nm. a) 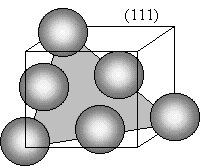 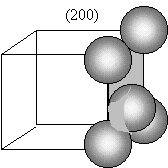 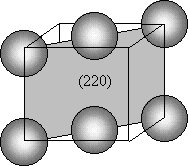 b) Empleando la ley de Bragg, para n=1, y para l = 0,1542 nm Problema 3.16 El hierro puro presenta las formas alotrópicas: Fe a (c.c.) de parámetro reticular a = 2.90 · 10-10 m y a 910°C se transforma en Fe g (c.c.c.) de parámetro reticular a= 3.65 · 10-10 m. Se pide: a) Demostrar si dilata o contrae al pasar de hierro a a hierro g.a) El Fe a, al ser cúbico centrado en cuerpo tiene 2 átomos por celdilla, mientras el Fe g al ser cúbico centrado en cuerpo tiene cuatro átomos por celdilla. Por ello, el volumen para el mismo número de átomos, por ejemplo cuatro, sería: Para el Fe a : V = 2 · (2.90 · 10-10)3 = 48.778 · 10-30 m3,b) La densidad se calculará a través de la expresión:
|
|
|
|
|
 |